簡単なミートソースのスパゲティーをじっくりと味わってから、カスパルとブルーノは皿洗いを始めた。食事を作らなかった方が片付けをするルールである。
午後の講義まで少し時間がある。ブルーノが食器を拭いている間、エミーは一生懸命周期表を書き殴っていた。
リタから大量の古紙をもらったので、一枚選んで羽根ペンを走らせる。



ごちそうさまでした


簡単なミートソースのスパゲティーをじっくりと味わってから、カスパルとブルーノは皿洗いを始めた。食事を作らなかった方が片付けをするルールである。
午後の講義まで少し時間がある。ブルーノが食器を拭いている間、エミーは一生懸命周期表を書き殴っていた。
リタから大量の古紙をもらったので、一枚選んで羽根ペンを走らせる。



それくらい簡単だろう


ブルーノの心無い一言にいちいち傷ついている暇はない。



私にとっては大変なんですー


気が散って覚えられない。ふくれっ面で暗唱を続ける。
リタが5人分の紅茶を淹れてくれた。大きくて透明なポットに柑橘系の香るアールグレイ。エミーはミルクと砂糖をたっぷりいれ、ゆっくりと飲み始めた。
集中を解いてほっと一息つく。これからは商店の手伝いがない分、自由な時間が増える。
だが新しい生活に浮かれて、のんびり遊びに行ってる場合ではない。勉強にあてなければ。
エミーは暗唱を再開した。きっと午前中の授業なんか、ブルーノにとっては簡単なのだろう。でも私はまだまだこれから。
ブルーノはまだ何か言いたそうだったが、エミーの邪魔はやめようと思ったのか、難しそうな本を取り出して紅茶を片手に読み始めた。



午前の続きで、原子について話し忘れたことがいくつかある


ー原子の構成表示ー
ー同位体ー



原子を表すとき、いちいち原子核やら電子やらを描いている暇はないだろう





そこで、簡単に原子を表す方法について述べる。【原子の構成表示】という。





例えばヘリウム4の場合、こう書く






Heはヘリウムのことだ、いいな。そして左肩の数字が質量数、左下が原子番号になる。





では問題だ。質量数35の塩素の構成表示を黒板に描いてみてくれ。はい、エミー





えっ、いきなりですか。えーと、塩素の原子番号はー





そうだな、周期表を用意してやろう。ほい


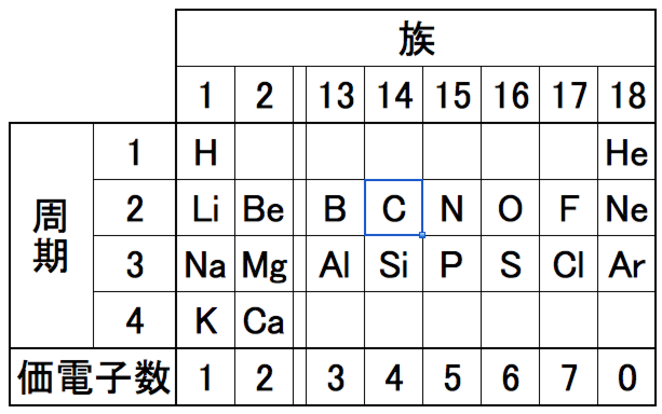



えーとNeで10だから、原子番号は17ですね





ということは。塩素Clの左肩が35で


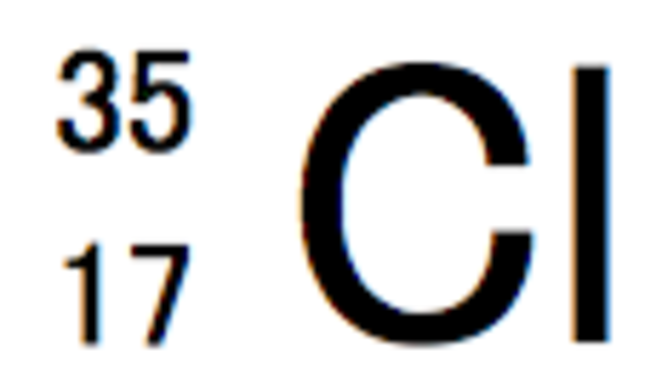



できました





いいだろう。





では次に中性子の話をしよう





原子核は陽子と中性子から成る。だが化学で重要なのは陽子の方だ。





原子の中には、陽子の数は同じーつまり同じ元素でありながら、中性子の数が違うものが存在する。





これを同位体という





周期表の同じ位置にあるから同位体なんですね





こら、私のセリフをとるんじゃない





すみません……ふふ


してやったりという顔である。優秀なのはよくわかったから。



ごほん。例えば水素には、中性子を持たないもの、中性子を1つだけ持つもの、中性子を2つ持つものの3種類が存在する。





自然界にある水素の99.9885%は中性子を持たない。0.0115%は中性子を1つ持つ。





2つ持つ水素はどのくらいあるんですか





パーセントでは表せないくらい極微量だ。





この比率は、人工的に操作しない限り自然界においては常に一定だ。





この比率のことを【天然存在比】という





この天然存在比はのちに大事になる。もちろん数字を覚える必要はない。





同じ元素でも中性子の数が違う原子が存在し、その比率は一定。このことが重要だ。覚えておくように





同じ元素で、中性子の数が違うのがあって、その割合は一定、ですね





そうだ。その同位体だが、中には放射線を出すものがある。それを放射性同位体という





例えば水素3、炭素14、カリウム40、ウラン235などがそうだ。





これは深入りすると物理学の範囲になるのでこれ以上は述べない。





ここまでで一旦原子の話を終える。





何か質問はあるか





原子の構成表示ってどんな時に使うんですか





普段は使わない。中性子の数、つまり質量数を区別したいときだけ特別に使う。





普段は元素記号だけ書いておけばいい。質量数も覚える必要はない。





では、いいかな。これからは主に電子の話だ


ー電子が入る場所(電子殻)ー
ー安定な電子配置(希ガスの電子配置)ー



最初の講義で言ったことを覚えているか





しつこいが、化学反応とは【原子と原子の間での電子のやりとり】のことだ





だから電子のことを知るのは非常に重要だ





電子は原子核の周りを回っている





水素原子の図を見せよう


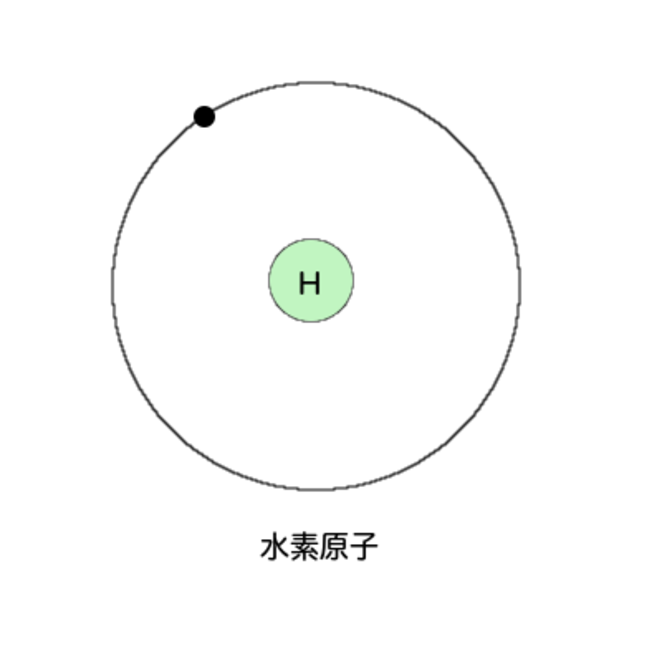



小さな原子核の周りを電子が1つ回っている。電子の数は、陽子と同じ数だったな





次はヘリウムだ。原子核の周りを電子が2つ回っている。


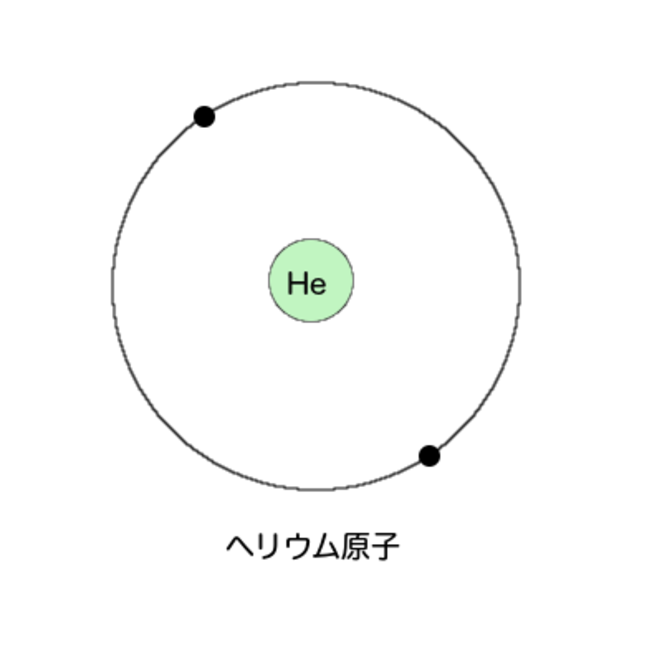



さて、次の原子番号3番、リチウムの電子はどのようになっているだろうか?





予想してみよう。予想してみないと、結果に驚けないからな





ブルーノ、は知ってそうだからエミー





その輪っかに3つの電子が回っているんじゃないでしょうか





普通はそう思うだろう。だが実際には違う。





さらに外側にまた大きな輪っかがあって、そこに1個だけ入る





内側に2つ、外側に1つだ


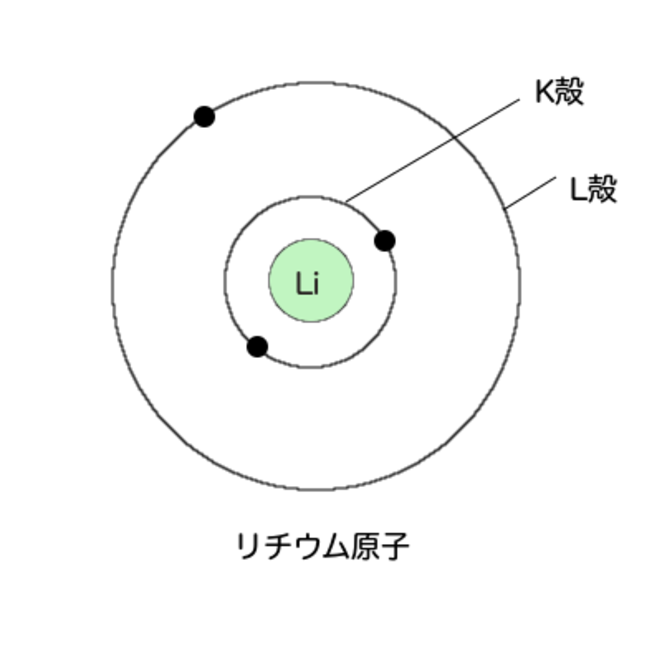



さらに外側にも輪っかがあるんですね





そうだな。この輪っかのことを電子殻という





一番内側の電子殻をK殻という。





二番目の電子殻はL殻、三番目はM殻だ。アルファベット順にな。





なぜアルファベットのAから始めないんですか





最初に電子殻を見つけた人が「内側にも殻があるかもしれないと考えて,念のため11番目のアルファベットをあてたのだ」





実際にはK殻が一番内側だったんだがな





この電子殻には定員がある。電子を無限に受け入れることはできない





K殻の定員は2個だ。





L殻の定員は8個。その次のM殻は18個入る。





その次のN殻には32個入る。これ以上は普通使わないからいいだろう。





電子殻の定員まで電子が入ると次の殻に移るんですね





と、思うだろう。その予想は裏切られる。





そうなんですか。





しばらくはその考え方でもいいのだが、あとで説明しよう。





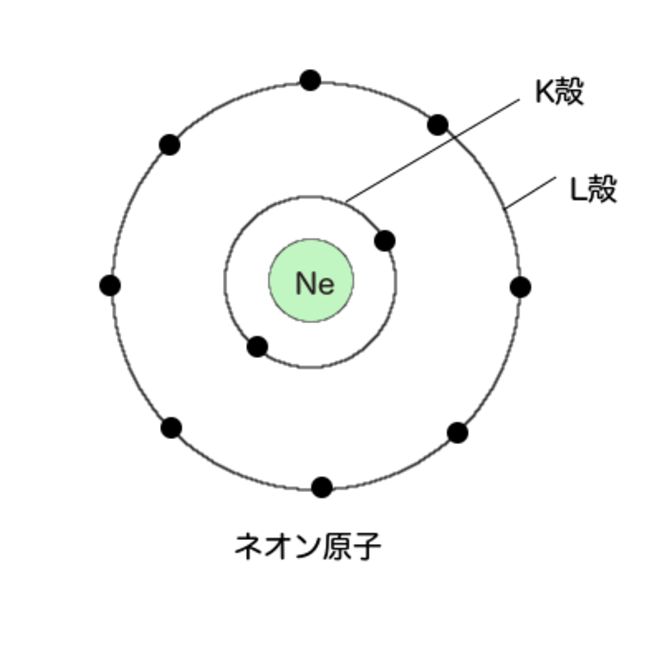
とりあえず、L殻が満員になる図を見てみよう。





10番元素、ネオンだ。





その次、ナトリウムの図はどうなるかわかるだろう。エミー描いてみよう





はい


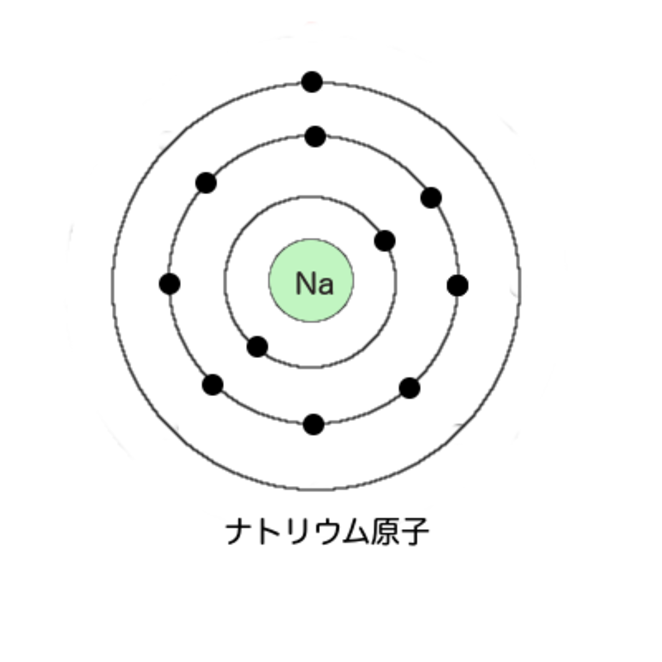



よろしい。





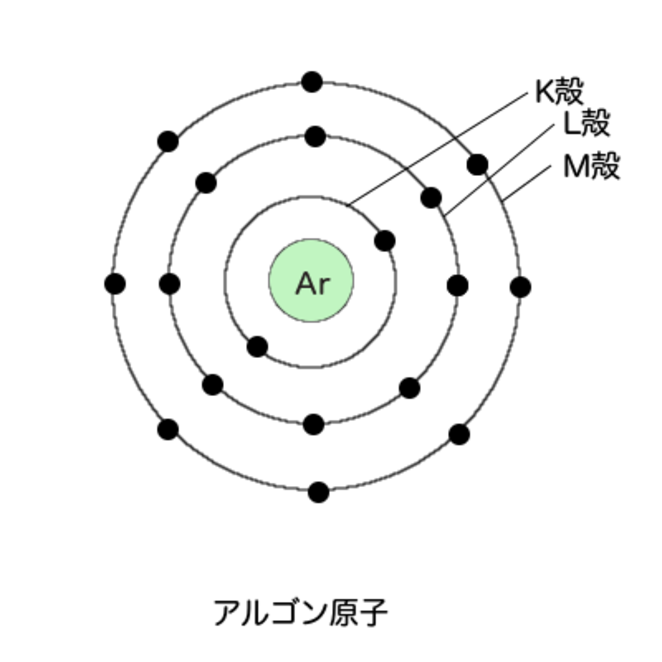
ここからアルゴンまでは、描かなくてもいいな。外側の殻に一つずつはいる。





さて、問題はここからだ。





M殻は18個の電子を入れることができる。しかしカリウムの19番目の電子は、M殻に入らない





N殻に入るのだ。


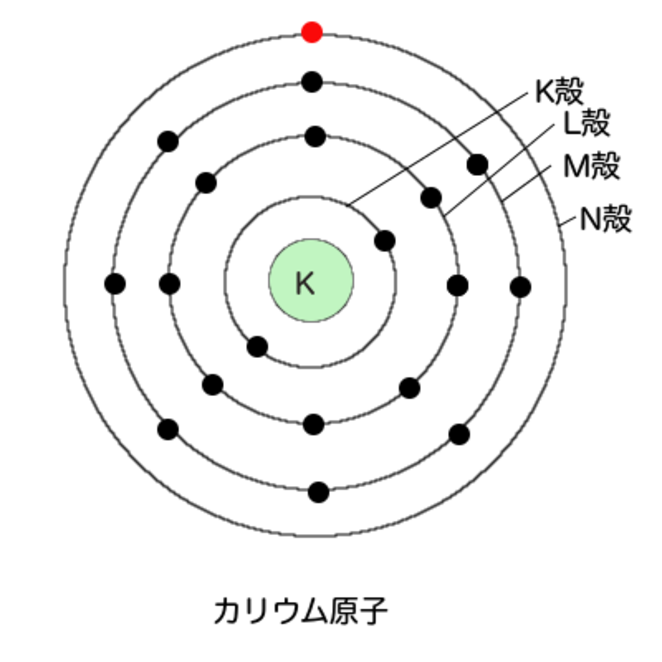



なぜか、というのは少し発展的な話なので興味があればあとで聞いてくれればいい





今まで見てきたような、電子の入っている場所の状態のことを【電子配置】という。





電子配置といっても、すべての電子が大事なわけじゃない





原子と原子の間でやりとりされる電子は一番外側にあるものだけだ。





だから一番外側にある電子の数が非常に重要である。





この電子のことを、特別に【最外殻電子】と呼ぶ。





響きは難しそうだが、分解して考えてみればわかるだろう。最も外側の殻にある電子のことだ。





この最外殻電子の数はいちいち電子配置を描かなくてもわかる。





ここで周期表が鍵になるのだ





族と書いた数字があるだろう。族の下一桁がそのまま最外殻電子数になる





つまり縦に並んだ元素の最外殻電子数は同じだ





最初に言ったが、周期表の縦に並んだ元素は性質が似ている。その理由は最外殻電子数にある。





ここで、安定な電子配置というものを教えておこう





周期表一番右の元素を【希ガス】という





ヘリウム、ネオン、アルゴン、クリプトン、キセノン、ラドンが希ガスだ。





これらの電子配置を見てほしい。ヘリウムの最外殻電子数は2、それ以外は8だ。





このような、【最外殻に8個入った状態】が原子にとって最も安定なのだ。





この際、内側の電子殻が電子でいっぱいになっている必要はない。一番外側が8個あると安定する。





内側が空いていても一番外が8個あると安定だ。





これを【希ガス原子の電子配置】という





希ガス原子の電子配置は後々出てくるから頭に入れておいてほしい





ここまではいいかな





一番外側にある電子の数が重要、ということですね





まあだいたいそういうことだな





その一番外側にある電子なんだが、他の原子と結合するときに重要な役割を果たす





他の原子と結合するときに重要な役割をする電子のことを【価電子】という





??最外殻電子とはどう違うんですか





ほとんど同じだが、少しだけ違いがあるんだ





一番大事な違いは、希ガスだ。そして今はこれだけ知っていればいい。





希ガスの最外殻電子は8個ある。しかしその8個の電子は普通化学反応をしない





そのため希ガスの価電子数は0とする決まりがある





希ガスの最外殻電子数は8個だけど、反応に関わらないから価電子数は0ということですか





そうなるな。その「反応に関わるかどうか」が厄介で、他にも細かい例外はあるのだが、アカデミーに入るまで知る必要はないだろう





次回は元素の周期表について詳しく見ていく。本日はここまで





明日は講義前に周期表のテストを行う。準備しておくように。





講義時間外に質問があるときは、カスパルかリタにその旨伝えること。





就寝時刻前なら夜間でも構わない





では自由時間とする。夕食の買い物よろしく。


ルイーゼは足早に講義室を去った。



早速質問があるんだけどどうしようかな





ルイーゼくんは今日の講義わかった?





余裕余裕





うーん、やっぱりそうだよね……





何かわからないことあるの?





うー。





いまいち整理できてなくて、何がわかんないのか、わかんないんですよね。





それじゃ答えられないね。





いいよ、リタさんに相談するから





そうだね。それがいいよ。じゃあ俺はルイーゼ先生に質問してくる


そういうとルイーゼを追いかけて足早に講義室を去った。



熱心だなあ


今日の講義もまだあやふやな私と比べて、さらに深い質問までしにいくなんて。



わたしなんかまだまだだなあ。





1日目の講義はどうだった?





うーん。やっぱり周期表が不安です。





それに、午後にやった電子配置?の話もまだついていけてません





そうねーいきなり大事なことがたくさんだものね





何が大事なのか、よくわからないんですよ。





そうね、そういうのって後からわかるものなのよ





そうなんですか。今知りたいなあ……





じゃあ夜に少しだけ復習する?





お願いします。





おいしい!





エミーちゃん料理上手ね


リタから聞いた通りルイーゼ好みの甘目の味付けにしたところ、あらわにはしなかったが本人も気に入った様子だった。
リタとカスパルからも好評が相次ぎ、ブルーノも素直に



すごくおいしい


と一言漏らしていた。
料理は家で小さい頃から習っていたので、苦手ではない。
レシピがあればそんなに難しい料理ではないのだが、家では当たり前のことだったので、リタ達に褒められたのは嬉しかった。



さて、エミーちゃん


女子寮に戻ってからの自由時間。早速復習の時間になった。



はい。





じゃあ何から始めましょうかー





はい……。周期表は自分で頑張ってみるので、午後の講義の方をお願いします





そうしましょっか。ノートはある?





あるんですけど、ルイーゼ先生あんまり板書してくれなくて





あー確かに単語と図だけが転がってる感じね。わかった。


リタは大量の古紙から一枚選んで机に置いた。



まずはナトリウムの電子配置、描いてみよう





周期表は見ていいけど、ノートは見ないでね





えーっと、原子番号は11だから





一番内側が2個





その次が8個で、最後に1個






できました





いいわ。この場合、最外殻電子はいくつ?





最外殻電子……





最も外側の殻に入っている電子の数





ああ、1個ですね。





そう。それで合ってる。





それで、大事なことが2つあるの





まず最外殻電子数は、周期表を見ればわかるということ





20番までだと下一桁が最外殻電子数になるわ。それ以降は例外があるんだけど。





例えば9番のフッ素は最外殻電子数が7個。試しに描いてみて。





えーっと





2個、のつぎが7個ですね


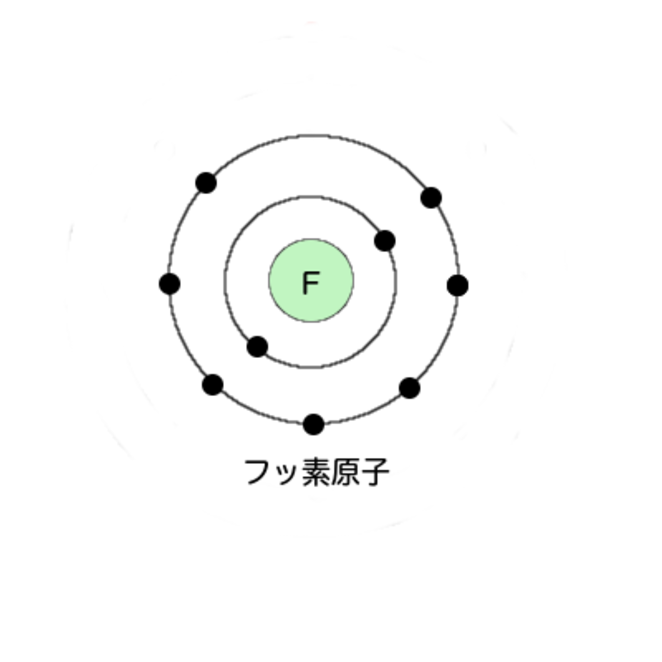



フッ素は17族……。あ、ほんとに同じ数だ





でしょ





それともう一つ。他の原子とやりとりをするのはこの最外殻電子で、元素の性質を決める重要な電子なの





だからこの最外殻電子のことを価電子ともいうのよ





そこの違いがわからないんですけど……





そうねー。もう同じものと思っていいわ。アカデミーまで行くと本当は例外があるんだけど





ルイーゼ先生も同じことを言っていました





そうね。でもいまのところ違いは1つだけ。それだけ覚えておこう。





【希ガスの価電子数は0とする】これだけ覚えておいて。それ以外は最外殻電子=価電子と思っていいからね。





わかりました。





さて、あとは周期表をしっかり覚えることね。がんばって





はい!


明日の試験が不安ではあるが、今はとにかく覚えるしかない。
エミーは古紙を何枚も使い、リタが入浴の順番を伝えに来るまで周期表を書きなぐった。
